Kliininen tutkimus saatettiin loppuun heinäkuussa 2020.
Tutkimuksen nimi (Tutkimusjakso 1): Faasi I-II satunnaistettu, kaksoissokkoutettu, lumelääkkeellä kontrolloitu tutkimus, jossa arvioidaan katetrin välityksellä aivoihin annosteltavan lääkeaineen CDNF:n turvallisuutta ja siedettävyyttä idiopaattista edenneen vaiheen Parkinsonin tautia sairastavilla potilailla.
Tutkimuksen nimi (Tutkimusjakso 2): Satunnaistettu, kaksoissokkoutettu, monikeskus-, aktiivihoito-, jatko- ja turvallisuustutkimus idiopaattista Parkinsonin tautia sairastavilla potilailla, jotka ovat olleet mukana loppuun saakka CDNF:n ja lääkkeenantolaitteen HP-CD-CL-2002 päätutkimuksessa.
CDNF-hoidon (eng. Cerebral Dopamine Neurotrophic Factor) tavoite on hidastaa Parkinsonin taudin kulkua ja lievittää taudin oireita. Koska tässä tutkimuksessa CDNF-tutkimuslääkettä annetaan ensimmäistä kertaa ihmisille, sen ensisijaiset tavoitteet koskevat CDNF-proteiinin ja lääkkeenantolaitteen turvallisuutta ja siedettävyyttä.
Herantis Pharma Oyj yhteistyössä Renishaw Plc -yhtiön kanssa.
Päätutkimuksen tutkimussuunnitelman hyväksyntä käsittäen leikkaukseen ja ensimmäiseen tutkimusjaksoon (Tutkimusjakso 1) liittyvät kokonaisuudet:
Tutkimusjakso 2 suoritetaan erillisen jatkotutkimussuunnitelman mukaisesti. Myös jatkotutkimuksella on viranomaisten hyväksyntä sekä Suomessa että Ruotsissa.
Tutkimusjakso 1 on rekisteröity ClinicalTrials.gov -tietokantaan numerolla NCT03295786 ja Euroopan lääkevirasto EMA:n EudraCT-tietokantaan (European Clinical Trials Database) numerolla 2015-004175-73.
Tutkimusjakso 2 on rekisteröity ClinicalTrials.gov -tietokantaan numerolla NCT03775538 ja Euroopan lääkevirasto EMA:n EudraCT-tietokantaan (European Clinical Trials Database) numerolla 2018-000346-19.
Tutkimukseen osallistuminen on täysin vapaaehtoista. Kuka tahansa tutkimukseen osallistuja voi muuttaa mielensä ja keskeyttää osallistumisensa milloin tahansa syytä ilmoittamatta ilman, että se vaikuttaa hänen saamaan nykyiseen hoitoon tai hoitoon tulevaisuudessa. Myöskään päätös olla osallistumatta tutkimukseen ei vaikuta potilaan hoitoon. Mikäli potilas päättää keskeyttää osallistumisensa, häntä pyydetään käymään vielä tutkimuksen lopetuskäynnillä oman turvallisuutensa vuoksi (sis. esimerkiksi viimeisen lääkärintarkastuksen ja laboratorionäytteiden oton).
Myös vastaava tutkimuslääkäri voi keskeyttää potilaan osallistumisen tutkimukseen milloin vain lääketieteellisistä syistä johtuen.
Potilastiedote, jossa kerrotaan päätutkimuksen (Tutkimusjakso 1) keskeinen sisältö, on saatavilla suomeksi:
Jatkotutkimukseen (Tutkimusjakso 2) liittyvä potilastiedote on myös saatavilla suomeksi:
Tutkittavan lääkkeen nimi on CDNF (Cerebral Dopamine Neurotrophic Factor). Se on proteiini, jota on ihmiskehossa luonnostaankin. Tässä tutkimuksessa tutkitaan sen kykyä ennaltaehkäistä dopamiinihermosolujen rappeutumista ja stimuloida hermosolujen uudistumista. Koska CDNF on proteiini, keho ei kykene kuljettamaan sitä aivoihin, jos sitä annetaan esim. tablettina tai injektiona. Tämän vuoksi tässä tutkimuksessa CDNF annostellaan neurokirurgin aivoihin asentaman lääkkeenantolaitteen avulla.
CDNF-proteiinia ei ole aikaisemmin tutkittu ihmisillä. Ensimmäisessä, ns. päätutkimuksessa CDNF-proteiinia verrataan lumelääkkeeseen. Potilaat satunnaistetaan yhteen kolmesta ryhmästä: 1) lumelääke-, 2) CDNF/keskisuuri annos- tai 3) CDNF/korkea annos -, kuusi potilasta ryhmää kohden. Kuuden kuukauden kuluttua ensimmäisestä tutkimuksesta (Tutkimusjakso 1), potilaita pyydetään osallistumaan jatkotutkimukseen, jossa kaikki osallistujat saavat CDNF-lääkevalmistetta (Tutkimusjakso 2).
CDNF-tutkimuslääkettä annetaan aivoihin katetrien kautta. Katetrit asennetaan neurokirurgisessa leikkauksessa aivojen putamen-alueelle (aivokuorukka) ja ne ovat yhteydessä korvan taakse kiinnitettyyn, portiksi kutsuttuun osaan. Lääkkeenantolaitteessa on myös suodattimet, jotka estävät bakteerien ja ilman pääsyn aivoihin.
Vastaava lääkkeenantolaite on aikaisemmin asennettu yli neljällekymmenelle potilaalle toisessa kliinisessä tutkimuksessa.
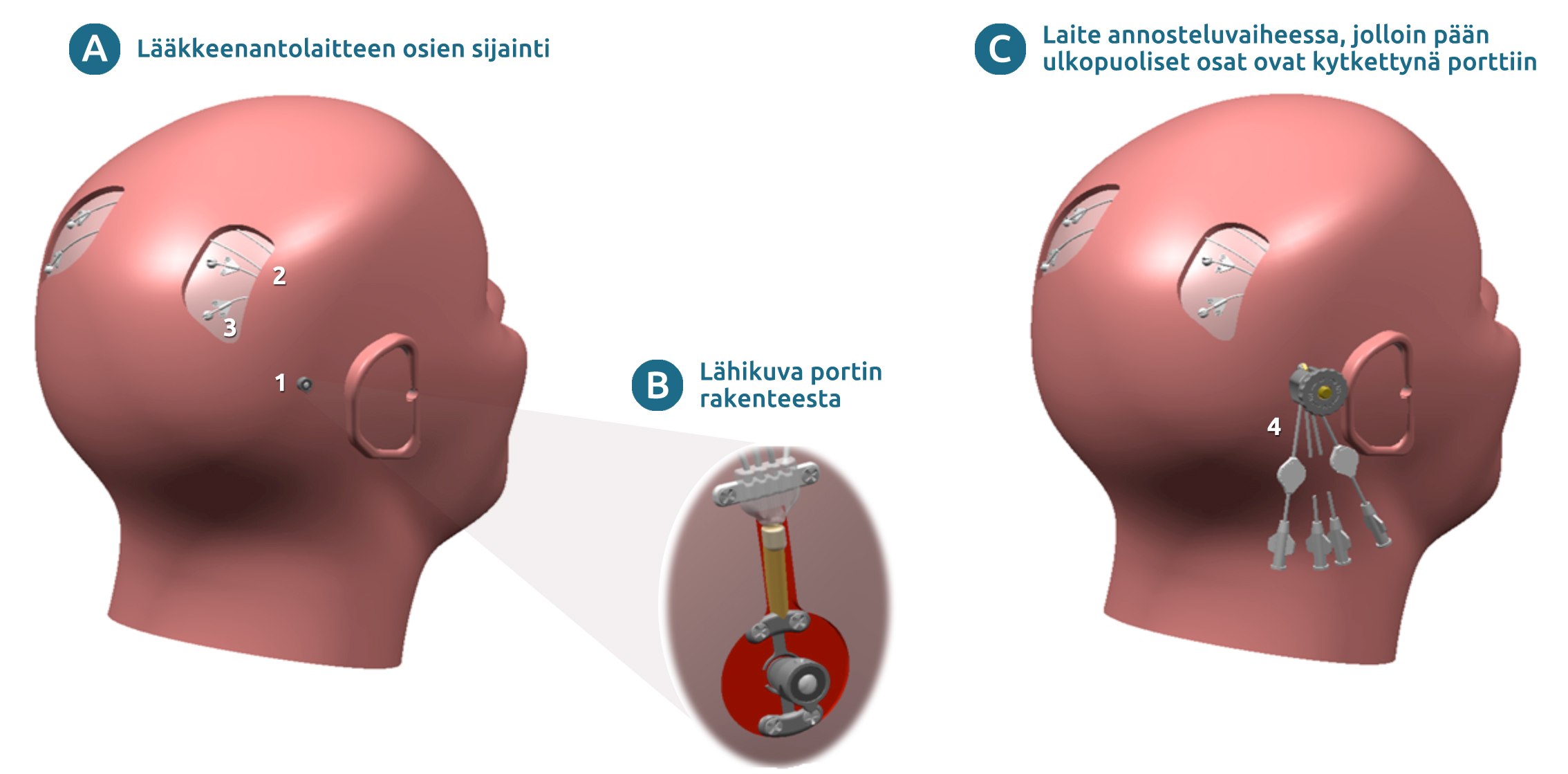
Kuva 1. Tutkimuksessa käytettävä lääkkeenantolaite. (A) Laitteen osien sijainti asennusleikkauksen jälkeen. (B) Lähikuva portin rakenteesta. (C) Laite annosteluvaiheessa. Pään ulkopuoliset osat on yhdistetty annostelua varten pään sisällä oleviin laitteen osiin. Laitteen osat: 1 = ihon läpäisevä portti kiinnitettynä kallon luuhun, 2 = ihonalaiset letkut, jotka yhdistävät portin katetreihin, 3 = katetrien sisäänmenokohdat aivoissa (x4) (Katetrien aivojen sisällä olevat osat eivät näy kuvassa), 4 = lääkkeenannon yhteydessä porttiin kiinnitettävät osat [neljä infuusiolinjaa (eivät näy kuvassa) kytketään näihin kohtiin annostelun alkaessa].
Tutkimukseen on otettu yhteensä seitsemäntoista potilasta. Tutkimukseen tullessaan heidän on tullut täyttää seuraavat kriteerit:
Potilaan soveltuvuus tutkimukseen on arvioitu yksityiskohtaisemmin seulontavaiheen aikana tutkimuksen alussa.
Potilaille, jotka eivät täytä osallistumisen ehtoja, on kerrottu esteenä olevista syistä. He saavat samat terveydenhuollon palvelut, jotka he normaalistikin saisivat.
Muutamalla käynnillä potilasta pyydetään keskeyttämään Parkinsonin taudin lääkitys viimeistään 10 tuntia ennen tutkimuskäyntiä. Normaalin lääkeannoksen voi ottaa heti, kun tutkimuskäynnin arvioinnit on suoritettu.
Potilaat yöpyvät sairaalassa tai hotellissa useampaan otteeseen tutkimuksen aikana, enimmäkseen yhden yön ajan paitsi leikkauksen jälkeen, jolloin he yöpyvät sairaalassa noin neljä yötä.

Kuva 2. Tutkimuksen aikajana ja tutkimuskäyntien sisältö. Kokonaisuus koostuu kahdesta kliinisestä tutkimuksesta, joilla on erilliset tutkimussuunnitelmat ja potilassuostumukset. Ensimmäinen tutkimus käsittää lääkkeenantolaitteen neurokirurgisen asennuksen sekä Tutkimusjakson 1. Tutkimusjakso 2 on yhtä kuin jatkotutkimus . Toisen tutkimusjakson jälkeen laite suljetaan poistamalla portti. Vaihtoehtoisesti myös koko laite voidaan poistaa tutkimuksen jälkeen.
Tutkimuslääkäri keskustelee potilaan kanssa muista saatavilla olevista hoitokeinoista sekä niiden hyödyistä ja haitoista. Tutkimukseen osallistuminen ei vaikuta normaaliin Parkinsonin taudin hoitoon ja potilaat jatkavat normaalia lääkitystään. Sen sijaan hoitoa muilla tutkittavilla lääkkeillä tai lääketieteellisillä laitteilla ei sallita tämän tutkimuksen aikana. Myös tiettyjen lääkkeiden käyttö on kielletty tämän tutkimuksen aikana. Tutkimuslääkäri keskustelee näistä lääkkeistä yksityiskohtaisesti potilaan kanssa.
Lääkkeenantolaitteen asennusleikkaus:
Lääkkeenantolaite:
PET-tutkimus:
CDNF:
Lääkärintarkastukset, laboratorionäytteenotot ja tutkimukset:
Tutkimuksen tarkoitus on arvioida CDNF-tutkimuslääkkeen ja lääkkeenantolaitteen turvallisuutta ja siedettävyyttä. Mahdollinen tutkimushoidon hyödyllisyys Parkinsonin taudin oireiden lievittymisessä arvioidaan, mutta on mahdollista, että potilas ei tule hyötymään tästä hoidosta. Tutkimuksen tulokset voivat kuitenkin auttaa Parkinsonin tautia sairastavia potilaita tulevaisuudessa.
Tutkimuslääkäri keskustelee potilaan kanssa parhaasta tutkimuksen jälkeisestä hoidosta hyvissä ajoin ennen sen päättymistä. Potilaalle kerrotaan saatavilla olevista, heidän sairauteen parhaiten soveltuvista hoitovaihtoehdoista. Korvan takana oleva lääkkeenantolaitteen portti poistetaan. Aivoihin asennettu lääkkeenantolaite jätetään paikalleen, ellei tutkimuslääkäri päätä toisin tai ellei potilas pyydä sen poistamista.
Tutkimuslääkäri ja toimeksiantaja ovat velvollisia ilmoittamaan potilaalle sellaisesta uudesta tiedosta, joka saattaa vaikuttaa hänen päätökseensä osallistua tutkimukseen tai jatkaa tutkimuksessa. Tutkimuslääkäri keskustelee tällaisesta tiedosta potilaan kanssa ja voi keskeyttää potilaan osallistumisen tutkimukseen, jos hän näkee sen parhaaksi vaihtoehdoksi potilaan kannalta.
Kaikki tutkimustulokset ovat luottamuksellisia ja niitä käsitellään ainoastaan koodinumeroa käyttäen. Tutkimuslääkärillä on lista, jossa potilaan koodinumero on yhdistetty henkilötietoihin, kuten nimeen ja syntymäaikaan. Tutkimustulokset saatetaan julkaista lääketieteellisissä tiedelehdissä ja esittää tieteellisissä konferensseissa, kokouksissa ja seminaareissa. Potilaiden henkilöllisyyttä ei kuitenkaan koskaan paljasteta missään raportissa tai esityksessä. Tutkimuksesta saatuja tietoja saatetaan antaa myös tarkasti määriteltyihin tarkoituksiin lääkeviranomaisille ja toimeksiantajan yhteistyötahoille, potilaan henkilötietoja ei kuitenkaan luovuteta.
Englanninkieliset kuvaukset pää- ja jatkotutkimuksesta ovat nähtävissä ClinicalTrials.gov -tietokannassa (NCT03295786 ja NCT03775538). Tutkimusten valmistuttua sivustolla julkaistaan yhteenveto tuloksista. Verkkosivusto ei sisällä tietoja, joista potilaat voitaisiin tunnistaa. ClinicalTrials.gov sivuston ohella tutkimuksesta saa tietoa projektikoordinaattorilta.
Mikäli potilas päättää keskeyttää osallistumisensa tutkimukseen, hänen suostumuksen peruuttamiseen mennessä kerättyjä tutkimustietoja käytetään tutkimuksen arvioinnissa.
Potilaalla on oikeus saada kerran vuodessa ilmaiseksi tietoa siitä, mitä henkilötietoja hänestä on kirjattu, mistä tiedot on saatu ja mihin niitä on käytetty. Potilasta rohkaistaan kertomaan tutkimuslääkärille hänen huomaamistaan mahdollisista vääristä tiedoista ja hänellä on oikeus pyytää niiden korjaamista.
Sen varmistamiseksi, että tutkimus on toteutettu ja tutkimustiedot on hankittu asianmukaisella tavalla, tietyillä valtuutetuilla henkilöillä on pääsy tutkimuspotilaiden sairauskertomuksiin. Tämän lisäksi lääkeviranomainen tai eettinen toimikunta saattaa pyytää edustajalleen oikeutta tutustua potilaiden sairauskertomuksiin tarkistaakseen, että tutkimus on toteutettu asianmukaisesti.
Normaali Suomen potilasvakuutus on voimassa myös kliinisessä tutkimuksessa. Lisäksi tutkimuksen toimeksiantaja on ottanut vakuutuksen, joka korvaa tämän tutkimuksen osallistumisen seurauksena syntyneitä potilasvahinkoja. Potilaan tulee ottaa yhteyttä tutkimuslääkäriin, mikäli hän uskoo kärsineensä tutkimushoidon seurauksena syntyneestä vahingosta.
Tutkimussairaala on saanut rahoitusta tutkimuksen toteuttamiseen Euroopan unionilta. Tutkimus on potilaalle ilmainen ja tutkimuskäynneistä aiheutuvat matkakustannukset ja mahdolliset ansionmenetykset korvataan.