Den kliniska studien fullbordades i juli 2020.
Studietitel (Behandlingsperiod 1): En fas I-II, randomiserad, dubbelblind, placebokontrollerad, säkerhet- och tolerabilitetsstudie av intermittent bilateral intraputaminal Cerebral Dopamin Neurotrofisk Faktor (CDNF) infusioner som ges via ett administreringssystem till patienter med idiopatisk Parkinsons sjukdom (PS) av måttlig svårighetsgrad.
Studietitel (Behandlingsperiod 2): En randomiserad, dubbelblind, multicenter, aktiv behandling, uppföljning- och säkerhetsstudie för patienter med idiopatisk Parkinsons sjukdom (PS) som tidigare har avslutat huvudstudien HP-CD-CL-2002 med CDNF/administreringssystemet.
Målet för behandlingen med CDNF (Cerebral Dopamin Neurotrofisk Faktor) är att bromsa förloppet av Parkinsons sjukdom och lindra symptom. Eftersom behandlingen ges för första gången till människan är de primära objektiven säkerhet och tolerabilitet.
Herantis Pharma Plc i samarbete med Renishaw Plc.
Huvudstudiens protokoll omfattande Operationen och Behandlingsperiod 1:
Behandlingsperiod 2 genomförs i enlighet med ett separat studieprotokoll som också har fått godkännande av kontrollmyndigheter i både Sverige och Finland.
Studierna är registrerade i databasen ClinicalTrials.gov med numrorna NCT03295786 och NCT03775538. Studierna är även registrerade i den europeiska databasen för kliniska studier (EudraCT) med numrorna 2015-004175-73 och 2018-000346-19.
Deltagandet i denna studie är helt frivilligt. Deltagare i studien kan när som helst under studiens gång välja att avsluta studien utan att behöva uppge någon särskild förklaring. Om en patient väljer att inte delta, eller att avsluta studien i förtid, kommer detta inte att påverka patientens nuvarande eller framtida vård. Om en patient väljer att avsluta studien, kommer hen att bli ombedd att av säkerhetsskäl genomgå ett uppföljningsbesök som innebär en medicinsk läkarundersökning samt ett antal provtagningar.
Deltagandet i studien kan också när som helst avslutas av ansvarig studieläkare på medicinska grunder.
Formulären för det informerade samtycket, som innehåller all relevant patientinformation är tillgänglig på både svenska och finska. Följande svenskspråkiga version av informerat samtycke för huvudstudien är tillgänglig:
Följande version av det informerade samtycket för förlängningsstudien är nu tillgänglig:
Studieläkemedlet kallas för CDNF (Cerebral Dopamine Neurotrophic Factor). Det är ett protein, som förekommer naturligt i kroppen. I denna studie studeras dess potential att förhindra dopaminproducerande neuroners död och nedbrytning samt att stimulera tillväxten av dessa celler. Eftersom CDNF är ett protein kan det inte tas som en tablett eller injiceras i ett blodkärl, eftersom kroppen inte kan transportera det vidare in i hjärnan. I denna studie kommer CDNF därför att ges med hjälp av ett administreringssystem, som en neurokirurg implanterar in i hjärnan.
CDNF har inte tidigare studerats i människan. I den första studien jämförs CDNF med en placebo-produkt i förhållandet 2:1. Patienter väljs slumpmässigt till antingen placebo-, CDNF-medeldos- eller CDNF-högdosbehandlingsgruppen med hjälp av en databaserad procedur. Efter en sexmånadersbehandlingsperiod i den första studien (Behandlingsperiod 1), erbjuds patienter att delta i en förlängningsstudie där alla patienter får det aktiva CDNF-läkemedlet (Behandlingsperiod 2).
CDNF-läkemedlet förs till hjärnan via katetrar (slangar), som en neurokirurg har implanterat in i de delar av hjärnan som kallas putamen. Katetrarna är anslutna till en port som är fastsatt i skallbenet, strax bakom örat. Systemet har också filter, som förhindrar att bakterier och luft kommer in i hjärnan.
Detta administreringssystem, för implantering och administrering av läkemedel, har tidigare implanterats i mer än 40 patienter i en annan klinisk studie.
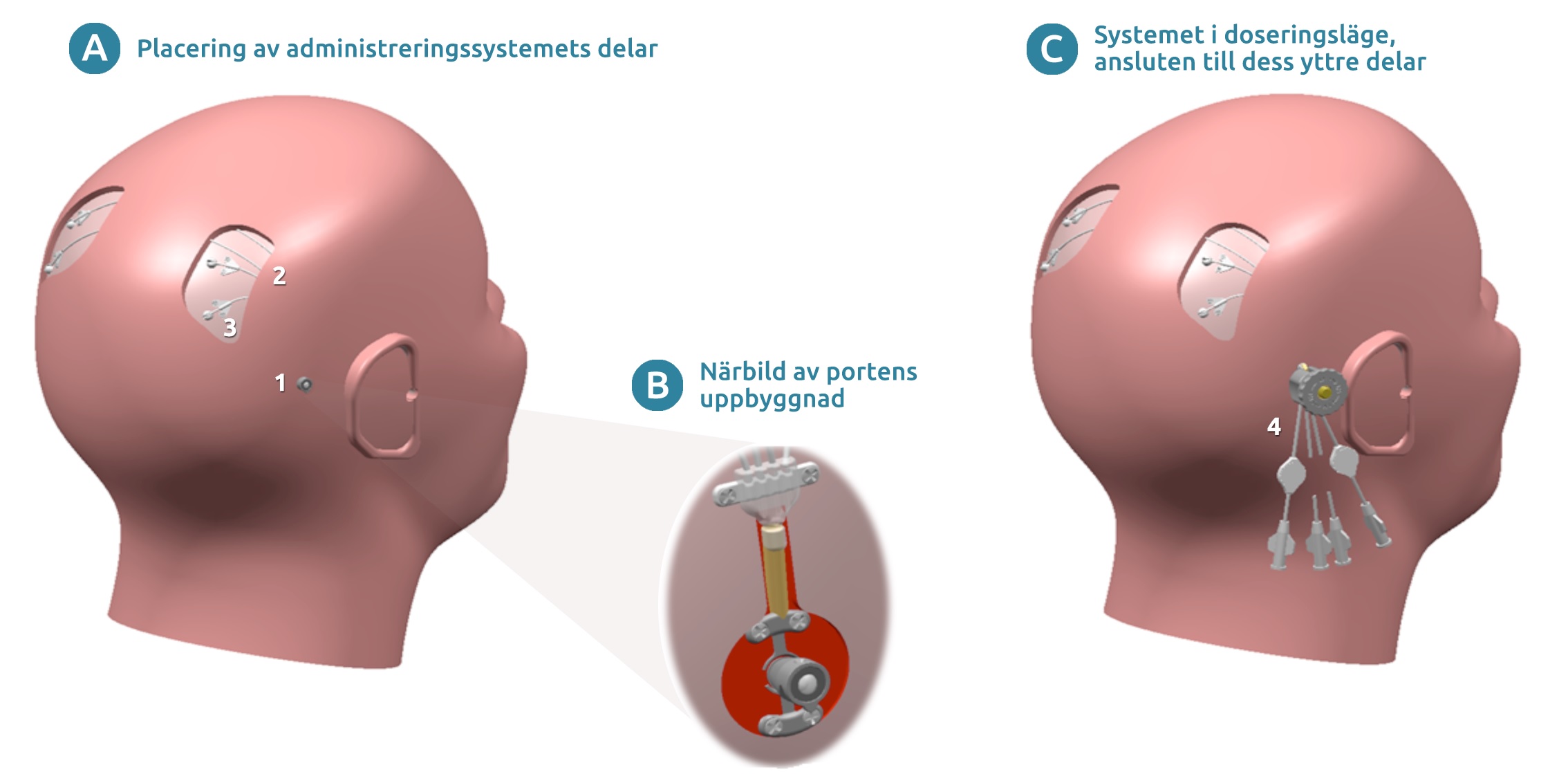
Figur 1. Administreringssystemet som används i studien. (A) Bilden visar de olika delarnas placering efter implantationsoperationen. (B) Närbild av portens uppbyggnad. (C) Systemet i doseringsläget, ansluten till administreringsuppsättningen för dosering. Lista på delarna: 1 = transkutan (genom huden) port som är fastsatt i skallbenet, 2 = subkutana (under huden) små slangar som ansluter porten till katetrarna, 3 = katetrarnas inträdespunkter (x4), de delar av katetrarna som går in i hjärnan visas inte, 4 = administreringsuppsättningen som är fastsatt till porten [yttre infusionsslangar (visas inte) ansluts till administreringsuppsättningen för dosering].
De sjutton patienter som deltar i studien uppfyller följande krav:
Patienternas lämplighet att delta i studien har bedömts i detalj under screeningfasen i början av studien.
De patienter som inte uppfyllt kraven för deltagande i studien har informerats om skälen till detta och fortsatt att få samma sjukvård som de normalt skulle få.
Inför flera av besöken kommer patienterna att bli ombedda att avstå från sin Parkinsons medicinering under minst tio timmar före besöken. Patienterna kan ta sin normala medicindos direkt efter besöken.
Patienterna kommer att behöva stanna kvar på sjukhuset eller i ett hotell flera gånger under studiens gång men oftast bara för en övernattning förutom efter operationen, då patienterna stannar på sjukhuset i ungefär fyra dagar.

Figur 2. Studiens tidslinje samt åtgärder under besöken. I den kliniska studien ingår två studier som genomförs enligt två skilda studieprotokoll och informerade samtycken som patienterna undertecknat. I den första delen av den kliniska studien ingår operationen, där administreringssystemet implanteras, och Behandlingsperiod 1. I den andra delen ingår Behandlingsperiod 2. Efter Behandlingsperiod 2, försluts systemet genom att avlägsna porten. Alternativt kan hela administreringssystemet avlägsnas efter studien.
Studieläkaren kommer att tillsammans med patienterna diskutera andra tillgängliga behandlingsmetoder, inklusive de fördelar och risker som de innebär. Deltagandet i denna studie kommer inte att påverka patienternas nuvarande behandling mot Parkinsons sjukdom och de kommer att fortsätta med sin nuvarande medicin. Dock är det inte tillåtet att ta något annat studieläkemedel eller behandlas med någon medicinteknisk produkt (som inte är godkänd för medicinskt bruk) under denna studies gång. Det finns även mediciner som inte får tas under studiens gång. Studieläkaren kommer att diskutera dessa mediciner med patienterna.
Operationen av implantatet:
Administreringssystemet:
PET-undersökningen:
CDNF:
Undersökningar och laboratorieprov
Syftet med denna studie är att utvärdera säkerheten och tolerabiliteten av studieläkemedlet och det implanterade administreringssystemet. En möjligt positiv behandlingseffekt på symptomen i Parkinsons sjukdom kommer att utvärderas men det är dock inte säkert att du kommer att ha någon fördel med att vara med i denna studie. Data från denna studie kan komma att gagna patienter med Parkinsons sjukdom i framtiden.
Studieläkaren kommer att individuellt med varje patient och i god tid innan studien är slut diskutera vilken som är den bästa behandlingen för dem. Patienterna kommer att informeras om alternativen för den bästa och mest effektiva behandlingen mot deras Parkinsons sjukdom.
Administreringssystemets port bakom örat kommer att avlägsnas. Det implanterade administreringssystemet kommer att sitta kvar i hjärnan, såvida det inte finns medicinska skäl till avlägsnandet eller om patienten inte ber om att det ska tas bort.
Studieläkaren och sponsorn är tvungna att berätta för patienterna om det kommer fram ny information under studiens gång som kan påverka deras beslut att fortsätta delta. Studieläkaren kommer då att diskutera detta med patienterna och kan möjligen besluta att det är bäst för en patient att avbryta sitt deltagande i studien.
All data från studien är konfidentiell och kommer att hanteras endast med hjälp av en patientkod. Studieläkaren kommer att förvara en kodlista som tillåter identifiering av dig personligen som endast studiepersonalen har tillgång till.
Resultaten från studien kommer eventuellt att publiceras i medicinska tidskrifter och presenteras under vetenskapliga konferenser, möten och seminarier. Patienternas identitet kommer hur som helst inte att avslöjas i någon sådan rapport eller presentation. För specifika ändamål, kan information ges åt kontrollmyndigheter och till sponsorns samarbetspartners.
En engelskspråkig beskrivning av studierna finns tillgänglig på nätsidan ClinicalTrials.gov (NCT03295786 och NCT03775538). Denna nätsida kommer inte att innehålla information som skulle kunna identifiera dig som en deltagande patient men den kommer att innehålla ett kort sammandrag av studieresultaten. Nätsidan visar informationen endast på engelska men patienterna kan kontakta studiepersonalen när som helst för att på sitt eget språk få reda på vilken information som finns tillgänglig offentligt.
Om en patient bestämmer sig för att avbryta studien i förtid kommer de uppgifter som samlats in innan hen tog tillbaka sitt samtycke att fortsätta användas i utvärderingen av studien men inga nya uppgifter kommer att samlas in.
Patienterna har rätt att en gång per år kostnadsfritt få veta vilka personuppgifter som har registrerats om dem, varifrån uppgifterna hämtats och vilka kategorier av mottagare de eventuellt har lämnats ut till. Patienterna har även rätt att begära att felaktiga uppgifter om dem rättas. Alla patienter uppmuntras till att berätta för studieläkaren om de märker att felaktig information har dokumenterats.
För att säkerställa att studien har genomförts ändamålsenligt och för att säkerställa att data som samlats in om patienterna är korrekt, kommer vissa behöriga personer att ha tillgång till patienternas medicinska journal. En behörig representant från Läkemedelsverket, etikprövningsnämnden eller en utländsk läkemedelsmyndighet kan eventuellt be om tillgång till delar av patienternas medicinska journal för att kontrollera att studien genomförts ändamålsenligt.
Precis som i rutinsjukvård omfattas patienterna av den nationella Patientförsäkringen. Sponsorn har även tecknat en försäkring som täcker medicinska kostnader för skada som anses orsakad av patientens deltagande i studien. Om en patient anser att hen lidit skada till följd av studiedeltagandet kan hen vända sig till sin studieläkare.
Sjukhuset har fått finansiering från den Europeiska kommissionen för genomförandet av denna studie. Alla patienters deltagaravgifter kommer att ersättas, vilket inkluderar reseavgifter och eventuella inkomstförluster som uppstått i samband med studiebesök.